Investigadores del Centro Nacional de Biotecnología del Consejo Superior de Investigaciones Científicas (CNB-CSIC) y la Universidad del País Vasco han colaborado en el descubrimiento del mecanismo de funcionamiento de la chaperona DNAJA2, perteneciente a la familia de las llamadas Hsp40 o proteínas J, el más diverso dentro de las chaperonas. El trabajo, publicado en Nature Communications, desvela cómo las diferentes condiciones celulares afectan a su función.
Las chaperonas moleculares son un variado grupo de proteínas involucradas en la síntesis, plegamiento, prevención de la formación de agregados y degradación de las proteínas celulares. Debido a ese papel tan crítico en el control de la calidad de las proteínas, los errores en su funcionamiento están asociados a procesos cancerígenos y a distintas enfermedades degenerativas. Muchas de estas chaperonas pueden funcionar como moléculas individuales (monómeros), o en conjunto, desde dímeros a estructuras oligoméricas, y algunas varían su estado dependiendo de las circunstancias. Este trabajo muestra que la chaperona DNAJA2, de la familia Hsp40 (hasta ahora conocidas como auxiliares de las chaperonas Hsp70, pero cuyo papel se está mostrando cada día más importante), es una de las que puede actuar tanto como monómero como oligómero.
Los investigadores han observado que, en condiciones fisiológicas óptimas, la proteína DNAJA2 oligomeriza formando grandes estructuras tubulares cuya estructura han reconstruido mediante criomicroscopía electrónica con una alta resolución. Sin embargo, cuando se producen situaciones de estrés celular por choque térmico, estas estructuras tubulares se disocian dando lugar a dímeros que se unen a las proteínas afectadas (que adoptan formas erróneas por el choque térmico) con mayor afinidad que las estructuras tubulares, y las protegen para evitar una mayor agregación.
Jorge Cuéllar, investigador en el CNB-CSIC y uno de los primeros autores del trabajo destaca: “hemos observado que la variación del estado de oligomerización de DNAJ2 cambia su función de manera reversible, pasando de actuar como un agente plegador en condiciones fisiológicas a agente protector en forma de dímero en condiciones de estrés”. Para José María Valpuesta, también del CNB-CSIC y uno de los directores del proyecto, "este trabajo muestra la maleabilidad de muchas chaperonas que, en su papel de “vigilantes” en el control del estado general de las proteínas, transforman sutilmente su función -mediante el cambio de su estructura- para lidiar con distintas situaciones celulares como el estrés térmico o de otro tipo".
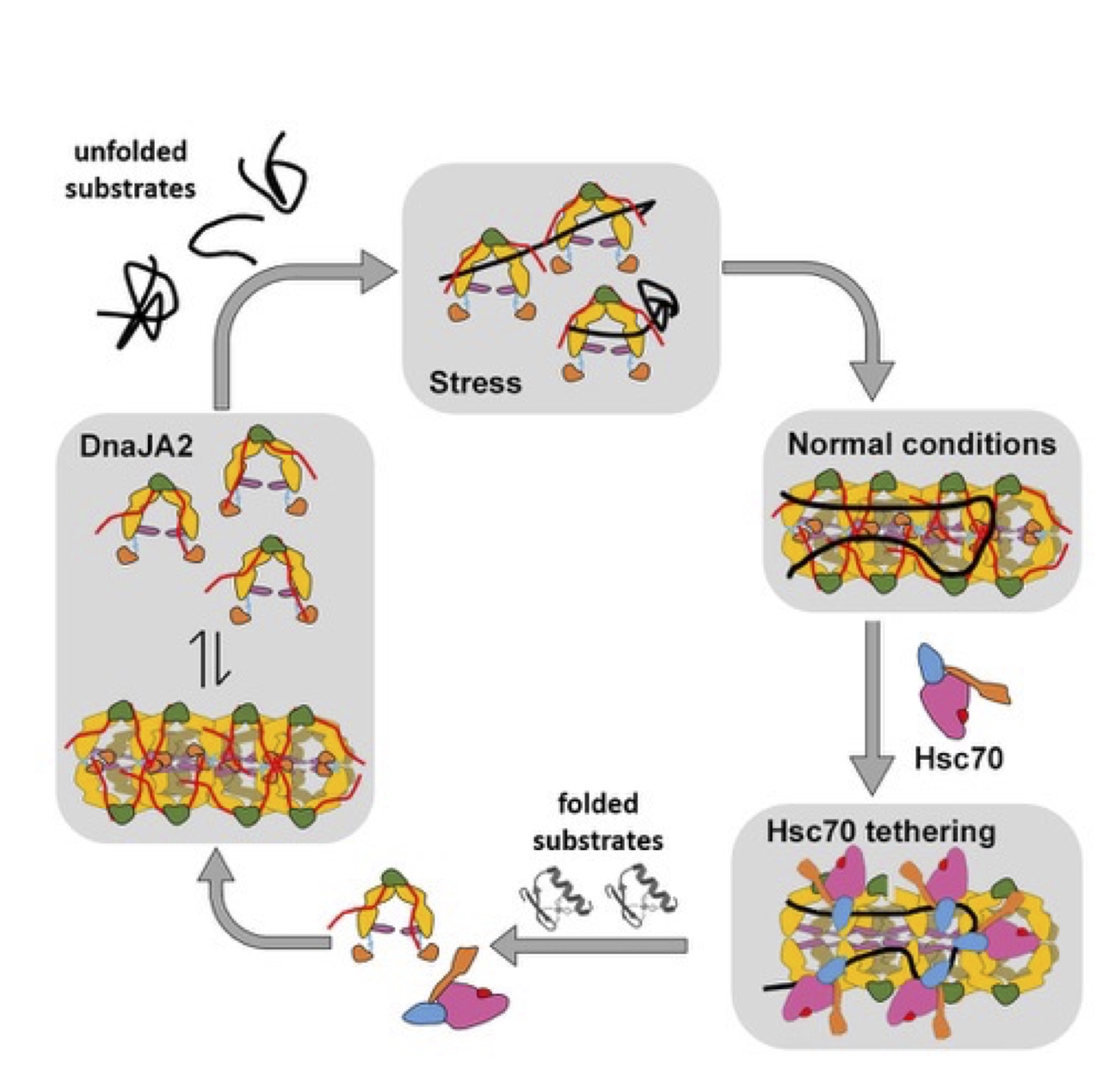
2ª Imagen : Modelo del funcionamiento de DNAJA2: en condiciones normales, la chaperona se encuentra en forma de oligómeros ordenados y es capaz de reconocer sustratos desnaturalizado y asistir a la chaperona Hsc70 en su plegamiento. En condiciones de choque térmico, los oligómeros se desensamblan y su actividad fundamental es la de atrapamiento de los sustratos desnaturalizados y su protección mientras las condiciones del choque térmico se mantengan. JM Valpuesta, CNB-CSIC
Imagen principal:Imagen obtenida por criomicroscopía electrónica de la chaperona DNAJA2 formado oligómeros
Jorge Cuéllar, CNB-CSIC
Más información
Velasco-Carneros L, Cuéllar J, Dublang L, Santiago C, Maréchal JD, Martín-Benito J, Maestro M, Fernández-Higuero JA, Orozco N, Moro F, Valpuesta JM, Muga A. The self-association equilibrium of DNAJA2 regulates its interaction with unfolded substrate proteins and with Hsc70. Nat. Commun (2023). 14:5436. DOI: https://doi.org/10.1038/s41467-023-41150-8