Oryzon Genomics, S.A., la compañía española que desarrolla terapias experimentales epigenéticas innovadoras anuncia sus resultados y avances en el cuarto trimestre de 2021
ORYZON DESTINA 1,3 M€ EN LA PREPARACIÓN REGULATORIA DE LA SOCIEDAD PARA DAR CUMPLIMIENTO A LOS REQUISITOS DEL MERCADO AMERICANO (NASDAQ)
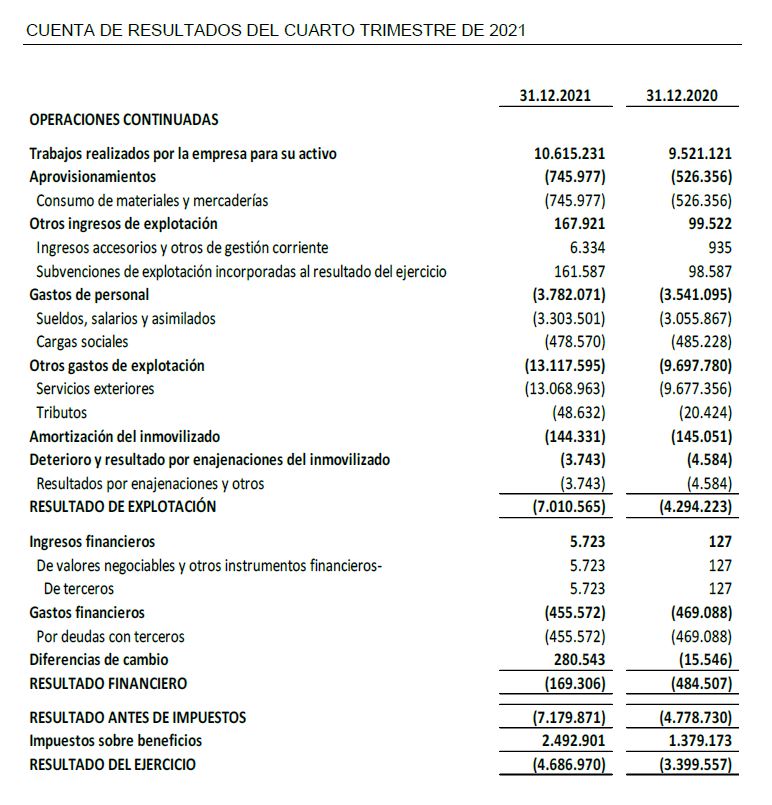
- El resultado negativo del ejercicio 2021 de 4,7 M€, aumenta un 38% con respecto al mismo periodo del ejercicio anterior de 3,4 M€, al haber incorporado actividades jurídicas preparatorias de cumplimiento regulatorio y auditorias bajo normativa PCAOB por 1,3 M€
- El resultado neto de actividades ordinarias excluida la dotación de recursos no recurrentes correspondientes al Nasdaq de 1,3 M€, y a las actividades de desarrollo clínico en el ensayo de FASE II ESCAPE en enfermos de CoVID-19 por motivos de Responsabilidad Social Corporativa de 1,0 M€, se sitúa en un resultado negativo de -2,4 M€ frente al del ejercicio precedente de -3,0 M€, lo que representa una mejora del resultado excluidas actividades no recurrentes de un 20%.
- Inversiones en I+D de 13,0 M€, de las cuales 11,6 M€ corresponden a desarrollo y 1,4 M€ a investigación, aumentan 1,9 M€ con respecto al ejercicio 2020, lo que supone una variación de un +18% respecto al mismo periodo del ejercicio precedente.
- Al cierre del cuarto trimestre el efectivo y las inversiones financieras disponibles ascienden a 28,7M€.
EVOLUCIÓN DEL NEGOCIO
Cuarto trimestre y otros destacados recientes
La compañía ha continuado avanzando en este cuarto trimestre en el desarrollo clínico de sus programas de oncología iadademstat y neurología vafidemstat.
Iadademstat en oncología:
- El ensayo de Fase II ALICE, que investiga el uso de iadademstat en combinación con azacitidina en leucemia mieloide aguda (LMA), ha completado el reclutamiento, con un total de 36 pacientes. Los resultados preliminares correspondientes a los 36 meses del estudio fueron presentados en el congreso ASH2021 el pasado mes de diciembre, mostrando señales robustas de eficacia clínica, con ORR del 78%, de los cuales el 62% eran CR/CRi, así como un un buen perfil de seguridad de la combinación de iadademstat y azacitidina. La duración de las respuestas observadas fue muy alentadora, con el 77% de las CR/CRi con duraciones de más de 6 meses. La remisión más larga en la fecha de corte de los datos para ASH-2021 era de más de 1.000 días, y sigue en curso, con el paciente que sigue siendo independiente de transfusiones y negativo para la ERM. La compañía tiene previsto presentar una nueva actualización clínica sobre ALICE en el congreso EHA-2022 y los datos finales en ASH-2022.
- La compañía está preparando nuevos ensayos en combinación en LMA y tumores sólidos. En LMA, la compañía planea iniciar FRIDA, un ensayo de Fase Ib/II en abierto y multicéntrico de iadademstat en combinación con gilteritinib en pacientes con LMA con mutación FLT3 que son refractarios o que han recaído. En cáncer de pulmón de célula pequeña (CPCP), la compañía está preparando el ensayo STELLAR. STELLAR es un ensayo de Fase Ib/II aleatorizado y multicéntrico de iadademstat con un inhibidor de punto de control inmunitario (ICI) en pacientes con CPCP metastásico en primera línea. Ambos ensayos se llevaran a cabo en EE.UU y ambos planean reclutar 120 pacientes. La compañía cree que FRIDA y STELLAR podrían potencialmente apoyar solicitudes de aprobación de comercialización acelerada.
- Oryzon ha publicado un artículo científico en la revista científica internacional ACS Pharmacology & Translational Science que respalda a iadademstat como el mejor en su clase en oncología. El artículo presenta una comparación exhaustiva de iadademstat con la mayoría de los inhibidores de LSD1 en desarrollo y muestra que iadademstat es sistemáticamente el compuesto más activo en diversas líneas celulares tumorales, que su capacidad de unión a la diana LSD1 es superior, especialmente a bajas concentraciones, y que la disrupción de los complejos transcripcionales implicados en los programas oncogénicos es más eficaz en el caso de iadademstat.
Vafidemstat en grandes trastornos multifactoriales del SNC:
- La compañía ha recibido la aprobación para el brazo serbio del ensayo clínico de Fase IIb PORTICO con vafidemstat en pacientes con Trastorno Límite de la Personalidad (TLP), completando de esta forma la fase de despliegue de PORTICO. El estudio está actualmente reclutando pacientes de forma activa en Europa y EE.UU. PORTICO es un estudio de Fase IIb multicéntrico, doble ciego, aleatorizado y controlado con placebo para evaluar la eficacia y seguridad de vafidemstat en pacientes con TLP. El ensayo tiene dos objetivos primarios independientes: la reducción de la agresividad/agitación y la mejora global de la enfermedad. El estudio incluirá 156 pacientes, con 78 pacientes en cada brazo, y cuenta con un análisis intermedio predefinido para ajustar el tamaño de la muestra en caso de una variabilidad excesiva en torno a las variables de evaluación o una tasa de placebo inesperadamente alta. El ensayo se llevará a cabo en 15-20 centros en Europa y Estados Unidos.
- La compañía ha iniciado el reclutamiento de pacientes en el ensayo clínico de Fase IIb EVOLUTION con vafidemstat en pacientes con esquizofrenia. Este estudio de Fase IIb evaluará la eficacia de vafidemstat sobre los síntomas negativos y la cognición en pacientes con esquizofrenia. Este proyecto está parcialmente financiado con fondos públicos del Ministerio de Ciencia e Innovación y se realizará en diversos hospitales españoles. Hemos activado varios centros clínicos durante este período.
Vafidemstat en trastornos monogénicos del SNC:
- La compañía ha seguido avanzando en la preparación de un nuevo ensayo de medicina de precisión en pacientes con síndrome de Kabuki (SK). Este ensayo de Fase I/II, denominado HOPE, será un ensayo multicéntrico, multibrazo, aleatorizado, doble ciego y controlado con placebo para explorar la seguridad y la eficacia de vafidemstat en la mejora de varias deficiencias descritas en pacientes con SK. El ensayo prevé reclutar a 50-60 pacientes y se realizará en niños mayores de 12 años y en adultos jóvenes. La compañía espera iniciar HOPE en la primera mitad de 2022 en varios hospitales y centros de EE.UU y, posiblemente, en Europa. Teniendo en cuenta los precedentes de la FDA y la EMA en enfermedades raras y trastornos del SNC, creemos que si el ensayo HOPE demuestra mejoras clínicas relevantes, podría servir de base para una aprobación acelerada en la UE y en Estados Unidos.
- Nuestros programas en medicina de precisión en enfermedad psiquiátrica continúan avanzando. Tenemos colaboraciones en autismo con investigadores del Centro Seaver de Investigación y Tratamiento del Autismo en la Facultad de Medicina Icahn en el Hospital Mount Sinai de Nueva York y con el Instituto de Genética Médica y Molecular (INGEMM) del Hospital Universitario La Paz de Madrid, y en esquizofrenia con investigadores de la Universidad de Columbia en Nueva York. Los resultados de los estudios piloto en marcha de caracterización de pacientes con mutaciones especificas, que servirán para informar posteriores estudios clínicos de psiquiatría de precisión con vafidemstat, se esperan que concluyan en 2022.
Información financiera del cuarto trimestre de 2021
El resultado neto del ejercicio 2021 de 4,7 M€ de pérdida, aumenta un 38% con respecto al mismo periodo del ejercicio anterior al haber realizado la Sociedad actividades jurídicas preparatorias de cumplimiento regulatorio y auditorias bajo normativa PCAOB por 1,3 M€, y actividades de desarrollo no capitalizada para contribuir en la lucha contra COVID-19 en el ensayo clínico ESCAPE por importe de 1,0 M€.
El resultado neto de actividades ordinarias excluida la dotación de recursos no recurrentes correspondientes al Nasdaq, y a las actividades de desarrollo clínico en el ensayo de FASE II ESCAPE en enfermos de CoVID-19 por motivos de Responsabilidad Social Corporativa, se sitúa en un resultado negativo de -2,4, M€ frente al del ejercicio precedente de -3,0 M€, lo que representa una mejora del 20%.
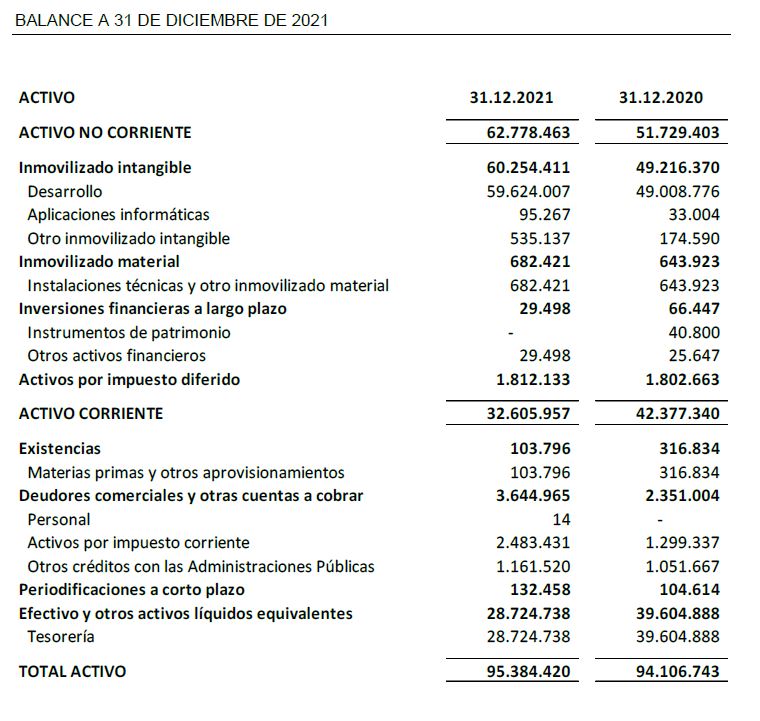
A 31 de diciembre de 2021, Oryzon mantiene una posición financiera con recursos financieros disponibles por importe de 28,7 M€ que le permite continuar con el desarrollo de sus actividades de I+D y el desarrollo de sus estudios clínicos de Fase II.
Oryzon ha intensificado sus Inversiones en I+D en el ejercicio 2021 con un aumento significativo de 1,9 M€ hasta alcanzar una cifra de 13,0 M€, lo que supone una variación de un +18% respecto al mismo periodo del ejercicio precedente. Las inversiones en I+D de 13,0 M€ corresponden a 11,6 M€ a actividades de desarrollo y a 1,4 M€ a actividades de investigación.
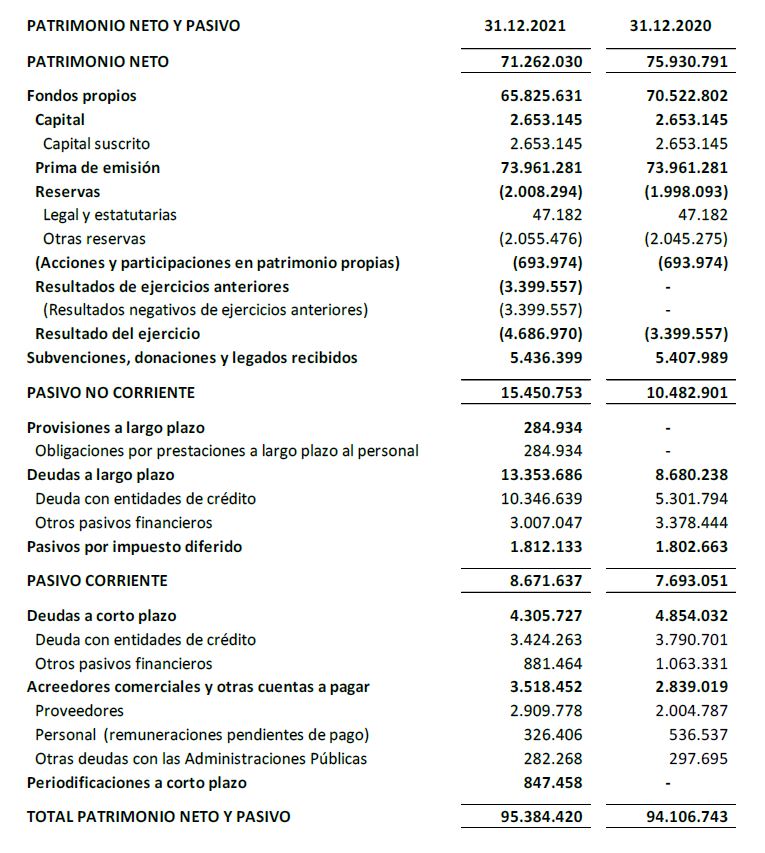
El balance a 31 de diciembre de 2021 presenta un patrimonio neto de 71,2 M€.
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en epigenética. Oryzon tiene una de las carteras más fuertes en el sector, con dos inhibidores de LSD1 en ensayos clínicos de Fase II, iadademstat y vafidemstat. Además, Oryzon cuenta con programas en curso para el desarrollo de inhibidores contra otras dianas epigenéticas. La compañía posee también una fuerte plataforma para la identificación de biomarcadores y valida biomarcadores y dianas para una variedad de enfermedades oncológicas y neurológicas. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495-511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer ensayo clínico de Fase I/IIa con iadademstat en pacientes con LMA recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi (ver Salamero et al, J Clin Oncol, 2020, 38(36): 4260-4273. doi: 10.1200/JCO.19.03250). En un ensayo de Fase IIa aún en curso en pacientes ancianos con LMA de primera línea (ensayo ALICE), iadademstat ha mostrado resultados alentadores de seguridad y eficacia en combinación con azacitidina. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos, meduloblastoma y otros. En un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea (ensayo CLEPSIDRA, ya finalizado), se han reportado resultados preliminares de eficacia. En total iadademstat ha sido probado en 4 ensayos clínicos en más de 100 pacientes.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es un inhibidor de LSD1 optimizado para SNC activo por vía oral. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se ha demostrado una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se ha observado actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Actualmente vafidemstat está en dos ensayos clínico de Fase IIb en pacientes con trastorno límite de la personalidad (PORTICO) y en pacientes con esquizofrenia (EVOLUTION). Oryzon también está desplegando un enfoque de medicina de precisión en SNC con vafidemstat en subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC.


