Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) y del Instituto de Investigación Sanitaria Princesa (IIS Princesa) en colaboración con investigadores del CIBER han descifrado, en gran parte, el mecanismo por el cual se incrementa la producción de especies reactivas de oxígeno (ROS) en las etapas tempranas de la hipoxia –disminución aguda de oxígeno-, una información clave para avanzar en el conocimiento de la fisiología celular y que podría ser usada para futuras terapias para el tratamiento de las distintas patologías en las que la hipoxia está involucrada, como un ictus o un paro cardíaco.
El estudio se publicado en Nature y es fruto de la colaboración entre los grupos dirigidos por Antonio Martínez Ruiz, del Hospital Santa Cristina en el Instituto de Instituto de Investigación Sanitaria Princesa (IIS Princesa) y CIBERCV, y José Antonio Enríquez, del CNIC y CIBERFES, y liderado por Pablo Hernansanz-Agustín, investigador post-doctoral del CNIC.
La mayoría de las células eucariotas dependen del consumo de oxígeno que se produce a través del sistema de fosforilación oxidativa mitocondrial (OXPHOS) para producir energía, explica el Dr. Enríquez. Además, continúa el investigador del CNIC, “este sistema produce, a partir del oxígeno, especies reactivas de oxígeno (ROS), unas entidades moleculares consideradas hasta hace poco tiempo sustancias tóxicas del metabolismo”.
Sin embargo, en bajas proporciones, estas especies reactivas actúan como señales capaces de impulsar adaptaciones celulares. De esta forma, asegura el Dr. Enríquez, “en los primeros minutos, tras disminuir las concentraciones de oxígeno, se generan las ROS que ejercen de señalizadores para iniciar la respuesta de adaptación celular a la deficiencia de oxígeno”.
En 2019, el Premio Nobel de Medicina o Fisiología se otorgó a los investigadores que descubrieron el mecanismo por el que se desarrollan respuestas a la hipoxia sostenida en el tiempo, que está mediado por los factores de respuesta a hipoxia (HIF). Sin embargo, el organismo tiene otras respuestas más rápidas a la hipoxia, que no dependen de HIF, y en las que participan las ROS. El mecanismo preciso por el cual se incrementa la producción de ROS en etapas tempranas de la hipoxia sigue siendo desconocido, pero gracias a este nuevo trabajo se tiene ahora un mejor conocimiento.
“Hemos determinado que el sodio (Na++) que entra en las mitocondrias actúa como un segundo mensajero regulando la función de la mitocondria -en concreto de la cadena de transporte electrónico mitocondrial-CTM- causando la producción controlada de ROS”, explica el Dr. Hernansanz.
Este mecanismo, a través de la producción de ROS, “es fundamental para la adaptación de la circulación sanguínea pulmonar a situaciones de hipoxia mediante la redistribución del flujo de sangre a zonas menos ventiladas, un fenómeno llamado vasoconstricción pulmonar hipóxica”, señala el Dr. Martínez.
Varios aspectos de esta investigación son claves para la fisiología celular, destacan los investigadores. Primero, la capacidad del sodio mitocondrial de regular la fluidez de membranas celulares, un aspecto desconocido hasta el momento y que podría tener grandes implicaciones en la regulación de multitud de procesos celulares.
Segundo, precisa el Dr. Enríquez, “la relevancia en este proceso de los supercomplejos mitocondriales, generando estructuras sensibles o insensibles al sodio dentro de la cadena de transporte electrónico mitocondrial permitiendo que la acción del sodio no sea tóxica”.
Además, añade el Dr. Martínez, la entrada de sodio en la mitocondria viene precedida de una solubilización del calcio que está depositado dentro de las mitocondrias, en unas estructuras que habían sido descritas hace más de 50 años, pero para las que hasta ahora no se conocía su función fisiológica.
Por último, “el trabajo también demuestra que la inhibición del intercambiador mitocondrial de sodio/calcio (NCLX) es suficiente para bloquear esta vía, evitando la adaptación a la hipoxia”, apunta el Dr. Enríquez. Este hecho, asegura, podría ser usado como terapia para las distintas patologías en las que la hipoxia está involucrada.
Los investigadores concluyen que sus resultados revelan que el sodio controla la función OXPHOS y la señalización celular en hipoxia a través de una inesperada interacción con fosfolípidos, con profundas consecuencias en el metabolismo celular.
En el estudio han colaborado investigadores del Centro Investigación Cooperativa en Biomateriales (CIC biomaGUNE); Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES); Instituto de Investigación Sanitaria Gregorio Marañón (IISGM); Centro Andaluz de Biología del Desarrollo-Universidad Pablo de Olavide-CSIC (Sevilla); Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER); Centro de Investigación Biomédica en Red de Fragilidad y Envejecimiento Saludable (CIBERFES), y Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV).
La investigación ha contado con la financiación de The International Human Frontier Science Program Organization (HFSP RGP0016/2018).
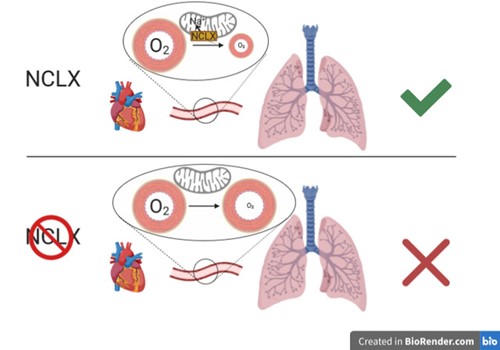
(*) Imagen: La figura ilustra el papel del intercambiador de sodio por calcio mitocondrial (NCLX) en la adaptación temprana a bajas concentraciones de oxígeno o hipoxia mediante la introducción de sodio dentro de la mitocondria. Esto se ve ejemplificado en la vasoconstricción hipoxia de la arteria pulmonar, que conecta el corazón con los pulmones. Ante la bajada de oxigeno se activa el transporte de sodio al interior de las mitocondrias y se inicia la señalización que active la constricción de la arteria. La eliminación del transportador NCLX de la mitocondria impide la correcta respuesta de la arteria a la bajada de oxígeno.
Referencia:
Na+ controls hypoxic signalling by the mitochondrial respiratory chain
DOI: 10.1038/s41586-020-2551-y